Hakusanaasi vastaavia tuloksia ei löytynyt.
Sisällöt
Uloskirjautumisesi onnistui.
Etkö ole vielä rekisteröitynyt?
Asetus lääkinnällisistä laitteista
Uusi eurooppalainen lääkinnällisiä laitteita koskeva asetus (MDR), sekä sitä seuraavat sääntömuutokset, vaativat ponnistelua kaikilta alan toimijoilta. B. Braun pyrkii soveltamaan uusia vaatimuksia mahdollisimman pian. Olemme koonneet tähän tietoa
MDR-asetuksesta.
Uusi eurooppalainen lääkinnällisiä laitteita koskeva asetus (MDR) tuli voimaan toukokuussa 2017. Uusi asetus korvaa nykyisen lääkintälaitedirektiivin (MDD) ja aktiivisen implantoitavan lääkinnällisen laitteen direktiivin (AIMDD).
Tällä hetkellä noin 500 000 lääkinnällistä laitetta Euroopassa sertifioidaan uudelleen uuden, huomattavasti kattavamman CE-merkinnän saamista koskevan menettelyn mukaisesti. Nykyisten arvioiden mukaan vain noin 65 prosenttia lääkinnällisistä laitteista sertifioidaan uuden asetuksen mukaisesti. Jotkin ilmoitetut laitokset ovat vielä nimeämisvaiheessa, eikä ole täysin selvää, kuinka moni ilmoitettu laitos pystyy päättämään prosessin (luettelo Euroopan komission verkkosivustolla). Ilmoitetuille laitoksille ja valmistajille asetettujen tiukempien vaatimusten vuoksi tuotevalikoimaan on tehtävä muutoksia, jotka ovat väistämättömiä.
MDD-todistus "lisäaika": Ei design-muutoksia MDD-sertifioiduissa tuotteissa
/
Tuotteilla on oltava allekirjoitettu MDR-hakemus (lukuun ottamatta loppuunmyytyjä MDD-tuotteita)
/
MDD-sertifikaatit pysyvät voimassa (aikataulu riippuu tuotteen riskiluokasta)
/
Tämä koskee muun muassa seuraavia alueita:
Jotta turvallista ja innovatiivistä lääketieteellistä teknologiaa voidaan toimittaa jatkuvasti, kaikkien valmistajien on täytettävä CE-merkinnän saamisen vaatimat tiukennetut vaatimukset. Ilmoitettujen laitosten on luotava perusta ja riittävä kapasiteetti vaatimustenmukaisuuden arviointimenettelyä varten.
B. Braun aloitti jo aiemmin laaja-alaiset valmistelut omien lääkinnällisten laitteidensa sertifiointiin MDR-asetuksen mukaisesti. Tämä koskee luonnollisesti kaikkia tuotteita, joita B. Braun valmistaa itse tai ostaa kaupallisina tuotteina täydentämään tuotevalikoimaansa. Toteutettujen toimenpiteiden etenemisen osalta B. Braun uskoo pystyvänsä täyttämään MDR-asetuksen vaatimukset toukokuuhun 2024 mennessä.
Lääkinnällisistä laitteista annetun direktiivin 93/42 ECC (MDD), joka julkaistiin vuonna 1993 ja joka on edelleen voimassa, uudistaminen tuli tarpeelliseksi Euroopan tasolla. Uudella asetuksella EU-viranomaiset haluavat parantaa lääkinnällisten laitteiden laatua ja turvallisuutta, yhdenmukaistaa prosesseja EU:ssa ja lisätä potilasturvallisuutta. Muita näkökohtia ovat läpinäkyvyyden ja jäljitettävyyden parantaminen uusien teknologioiden yhteydessä, jotka mahdollistavat kaikkien tuotteiden selkeän tunnistamisen koko niiden elinkaaren ajan.
MDR määrittelee vaatimukset, jotka valmistajan on täytettävä voidakseen myydä lääkinnällisiä laitteita Euroopassa. Tämä koskee sekä tuotteen teknisiä vaatimuksia että terveydenhuoltolaitoksissa käytettävien tuotteiden valvontaa.
Tuotteiden luokitteluun liittyy useita muutoksia. Uudelleenkäytettäville kirurgisille instrumenteille tarkoitetun uuden luokan lr käyttöönoton lisäksi luokan IIb implantoitaville tuotteille asetettuja vaatimuksia on erityisesti lisätty. Lisäksi monet tuotekategoriat on luokiteltu korkeampaan riskiluokkaan. MDR lisää vaatimuksia lääkinnällisten laitteiden kliiniselle näytölle. Jatkossa kaikki lääkinnälliset laitteet riskiluokasta riippumatta edellyttävät kliinistä arviointia. Uudella tarkastusmenettelyllä parannetaan uusien, riskiluokan III implantoitavien tuotteiden sekä luokan IIb lääkkeitä antavien ja/tai poistavien aktiivisten lääkinnällisten laitteiden valvontaa ennen markkinoille saattamista. Valmistajille asetettujen tiukempien vaatimusten lisäksi ilmoitetuille laitoksille asetetaan nyt tiukempia sääntöjä. Jotta lääkinnälliset laitteet voidaan hyväksyä, niiden on täytettävä useita lisävaatimuksia. Ilmoitetut laitokset ovat myös velvollisia suorittamaan valmistajille ennalta ilmoittamattomia auditointeja. Valmistajien toimitettavalle tekniselle dokumentaatiolle asetetut lisävaatimukset lisäävät merkittävästi dokumentaation laajuutta ja monimutkaisuutta.
Tuotteessa ei ole tarkkaa tunnistetta, joka osoittaisi MDR-yhteensopivuuden. Lääkinnällisten laitteiden etikettiin lisätään kuitenkin uusi ISO-symboli "MD", kun MDR otetaan käyttöön.
Kyllä, tämä koskee kaikkia lääkinnällisiä laitteita kaikissa riskiluokissa, mukaan lukien hoitoyksiköt ja -järjestelmät.
Yleisölle olennaiset tiedot ovat saatavilla jo olemassa olevassa eurooppalaisessa keskustietokannassa. EUDAMED:in laajennettu versio otetaan käyttöön vaiheittain eli "pienin elinkelpoinen tuote" (minimal viable product) MVP-version vapaaehtoinen käyttö vuodesta 2022. EUDAMED:in pakollisen käytön odotetaan tapahtuvan vuoden 2025 toisella neljänneksellä. Katso EUDAMED:in aikajana
Laillisten valmistajien, järjestelmä- ja toimenpidepakkausten valmistajien, maahantuojien tai lääkinnällisten laitteiden jakelua EU:ssa koskevien valtuutettujen edustajien on lisättävä EUDAMED:iin toimijan rooliin liittyvät tiedot sekä kunkin EU:ssa jaeltavan yksittäisen tuotteen tuotekohtaiset tiedot.
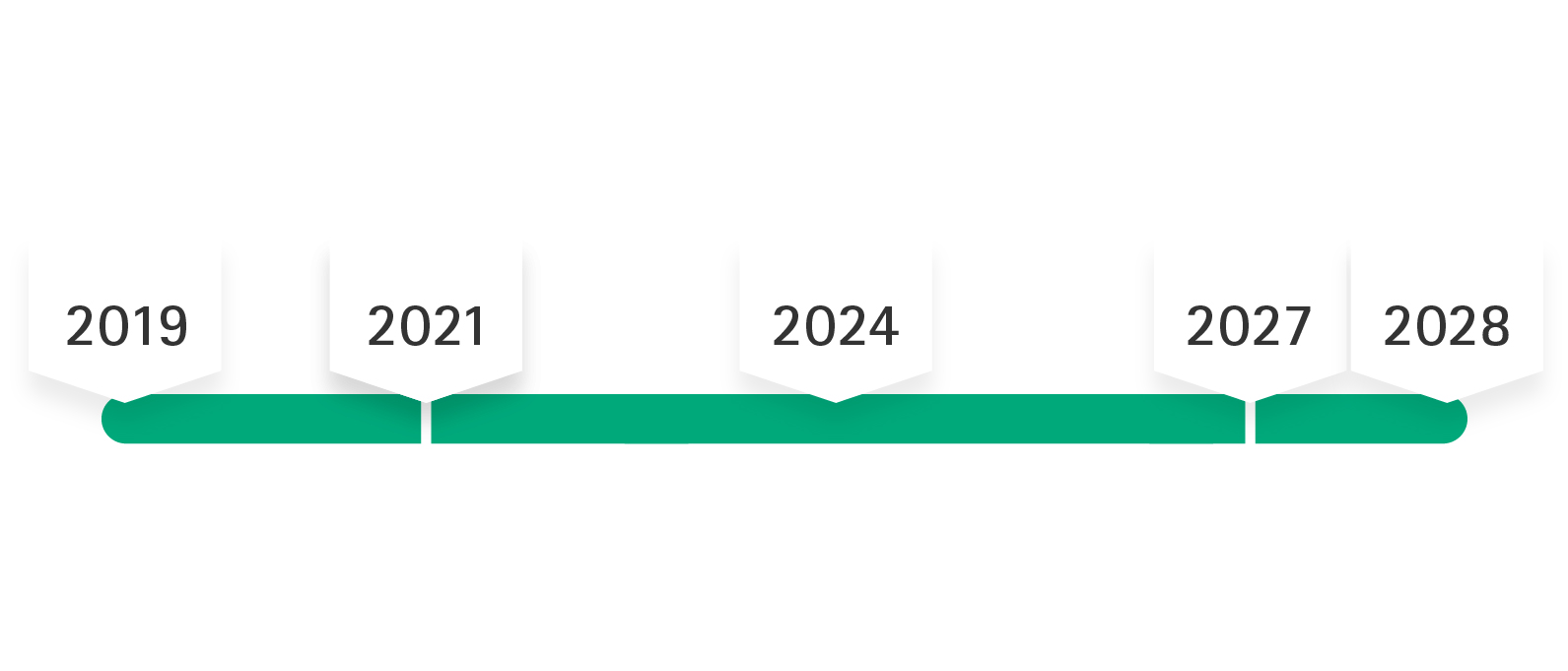
MDR julkaistiin 5.5.2017, minkä jälkeen asetus astui voimaan 25.5.2017. Siirtymäajan oli tarkoitus kestää 26.5.2020 asti. COVID-19-pandemian vuoksi MDR:n pakollinen soveltaminen siirrettiin toukokuuhun 2021. MDR:ään tehdyn 2. lisäyksen mukaan siirtymäaikaa pidennetään enintään joulukuuhun 2028, eli MDD-sertifikaatit pysyvät voimassa (eli vain enintään joulukuuhun 2027 asti riskiluokkien IIb implantoitavien ja III tuotteiden osalta), jos tietyt edellytykset täyttyvät.
Lääkinnällisistä laitteista ei saa aiheutua kohtuutonta vaaraa terveydelle ja turvallisuudelle.
Laadunhallintajärjestelmän on jo oltava MDR-yhteensopiva.
MDR-hakemus allekirjoitetaan toukokuuhun 2024 mennessä.
MDR-sopimus ilmoitetun laitoksen kanssa on allekirjoitettava syyskuuhun 2024 mennessä.
MDD-tuotteisiin ei tule merkittäviä muutoksia.
MDR:n 2. lisäyksen mukaan lopullista loppuunmyyntiaikaa ei enää ole. Aiemmin suunniteltu loppuunmyyntijakso (eli MDD-sertifioitujen tuotteiden jatkojakelu toukokuun 2025 jälkeen) on peruttu.
MDD-EC-sertifikaatin voimassaoloaikaa jatketaan automaattisesti (uusia sertifikaatteja ei myönnetä).
MDD- ja MDR-EC-sertifikaatit ovat voimassa rinnakkain pidennysjakson ajan.
Sekä MDD- että MDR-tuotteita voidaan saattaa markkinoille rinnakkain.
COVID-19-pandemian vuoksi MDR-asetuksen pakollinen hakemus asetettiin 26.5.2021. Tämä johtaa seuraaviin määräaikoihin lääkinnällisten laitteiden markkinoinnille tuoteluokittain:
Luokka I: 26.5.2021
Luokka Ir, s, m, luokka IIa, luokka IIb ja luokka III: 26.5.2024
Vaatimustenmukaisuusarviointi kertoo, täyttävätkö tuote ja vastaava valmistaja eurooppalaiset MDR-vaatimukset. Yksittäisten tuotteiden riskiluokituksesta riippuen B. Braunilla on oikeus suorittaa tämä tarkastus itse. Lisäarvioinnit tehdään ns. ilmoitetun laitoksen kautta.
Ilmoitettu laitos on yksityinen yritys, joka on nimetty Euroopan unionin puolesta arvioimaan valmistajan vaatimustenmukaisuutta MDR-asetuksen kanssa. Tällä hetkellä niitä arvioidaan auditoinneilla, ja kun ne ovat läpäisseet auditoinnit, ilmoitetut laitokset arvioivat lääkinnällisten laitteiden valmistajien prosessit MDR-vaatimustenmukaisuuden varmistamiseksi. Kun prosessien noudattaminen on varmistettu, käsiteltävät tuotteet voidaan rekisteröidä näiden prosessien kautta.
Vaikka koko tuotevalikoima olisi muutettu MDR-asetuksen mukaiseksi, valmistajille aiheutuu merkittäviä lisäkustannuksia MDR-asetuksen lisääntyneiden vaatimusten vuoksi.
Asetuksen päätavoitteet ovat kansanterveyden ja potilasturvallisuuden suojelu, läpinäkyvyyden lisääminen, oikeusturva ja eurooppalaisempi konsepti. Tämä saavutetaan laajemman teknisen dokumentaation avulla tuotteista, joita ongelma koskee, MDR-yhteensopivassa laadunhallintajärjestelmässä.
Asetuksessa (EU) 2023/607 säädetään, että 25.5.2017 mennessä lääkintälaitedirektiivin nojalla myönnetyt ja 26.5.2021 voimassa olevat todistukset pysyvät voimassa niiden vanhenemispäivästä riippumatta. Tämä tarkoittaa, että tuotteita, joiden lääkinnällisen laitteen vaatimustenmukaisuusvakuutus oli voimassa 26.5.2021 asti, voidaan edelleen saattaa EU:n markkinoille.
Tuotteita, jotka olivat jo markkinoilla ennen 26.5.2021 ja joilla oli MDD-vaatimustenmukaisuusvakuutus, voidaan edelleen saattaa markkinoille niin kauan kuin MDD-vaatimustenmukaisuusvakuutus on voimassa. Laajennettu voimassaoloaika on voimassa toukokuuhun 2027 saakka (riskiluokille III ja IIb implantoitavat) ja toukokuuhun 2028 saakka (kaikki muut riskiluokat – paitsi luokka I).
Asetuksella (EU) 2023/607 poistettiin lääkinnällisten laitteiden loppuunmyyntiaika, jonka oli alun perin tarkoitus päättyä 27.5.2025.
Valmistaja vahvistaa valmistajan omalla vakuutuksella (vahvistuskirje), että sen lääkinnällinen laite täyttää sovellettavat lakisääteiset vaatimukset. Asetuksen (EU) 2023/607 mukaan kaikkien niiden sertifikaattien voimassaoloa, jotka eivät olleet vanhentuneet 20.3.2023, jatkettiin 31.12.2027 saakka (luokkien III ja IIb implantoitaville tuotteille) tai 31.12.2028 saakka (kaikille muille tuotteille – lukuun ottamatta luokkaa I). Valmistajan on täytettävä seuraavat ehdot, jotta sertifikaatit ja vaatimustenmukaisuusvakuutukset pysyvät voimassa.
Lääkinnällisten laitteiden valmistajana B. Braunin on noudatettava MDR-asetuksen vaatimuksia. Eri työryhmät päivittävät teknistä dokumentaatiota ja tarkistavat prosesseja varmistaakseen, että ne ovat MDR-yhteensopivia. Lisäksi B. Braun on velvollinen toimittamaan tuotetiedot, mukaan lukien yksilölliset laitetunnistetiedot (UDI), sekä markkinoille saattamisen jälkeiset valvontatiedot EUDAMED:ille.
B. Braun -konserni on käynnistänyt kattavat toimenpiteet ja tarjonnut resursseja MDR-asetuksen toteuttamiseksi aikataulussa.
Kaikki lääkinnälliset laitteet.
B. Braun on jo jonkin aikaa valmistautunut uusiin määräyksiin ja olettaa pystyvänsä noudattamaan aikataulua.
B. Braun Melsungen AG:n, B. Braun Avitum AG:n ja Aesculap AG:n laadunhallintajärjestelmät on jo sertifioitu MDR:n mukaisesti, ja tuotteillemme on jo laadittu MDR:n mukainen tekninen dokumentaatio. Tuotteen siirto MDR:ään tapahtuu vaiheittain enimmäisajan puitteissa.
Yleensä kyllä – suunnitellusta elinkaaresta riippuen tuotteet on sertifioitu MDR:n mukaisesti. Aiempien vuosien tapaan B. Braun jatkaa tuotevalikoimansa mukauttamista. Portfolioon lisätään uusia tuotteita ja vanhemmat sukupolvet korvataan tai tuoteportfoliosta poistetaan epätaloudellisia tai vanhentuneita tuotteita. Osana säännöllistä valikoimanhallintaprosessiamme tiedotamme jatkossakin vastaavista tuotevalikoiman muutoksista oikea-aikaisesti, avoimesti, läpinäkyvästi ja kohdennetusti kyseisille asiakkaille ja tarjoamme vaihtoehtoja mahdollisuuksien mukaan.
B. Braun käyttää MDR-siirtymäaikaa, jonka aikana siirrämme tuotevalikoimamme MDR-asetukseen. Siirtymäaikana B. Braun tuo markkinoille sekä MDD- että MDR-sertifioituja tuotteita.
TÜV Süd hyväksyttiin toiseksi ilmoitetuksi laitokseksi maailmassa toukokuussa 2019. Muita ilmoitettuja laitoksia, jotka valvovat B. Braunin lääkinnällisiä laitteita, ovat MedCert, Dekra ja TÜV Rheinland, jotka ovat saaneet nimensä myös MDR:n mukaisesti. Katso linkki Euroopan komission verkkosivustolle saadaksesi yleiskatsauksen MDR-asetuksen akkreditoiduista ilmoitetuista laitoksista.
Euroopan komission verkkosivusto
a) Lääkinnällisen laitteen tunniste muuttuu, kun siihen lisätään yksilöllinen laitetunniste (UDI).
b) Uusista luokan III tuotteista voi aiheutua laajempia dokumentointivelvoitteita.
c) EUDAMED-tietokanta tarjoaa asiakkaille enemmän läpinäkyvyyttä tuotteisiin liittyen.
B. Braun on valmis MDR:ään ja on jo tehnyt suuria investointeja tämän saavuttamiseksi. Merkittäviä kustannustekijöitä ovat kattavammat vaatimukset tekniselle dokumentaatiolle, tekniset ja järjestelmälliset ratkaisut vaaditun EUDAMED-tiedonhallinnan täyttämiseksi sekä lisääntyneet markkinoilletulon jälkeiset valvontatoimet.
B. Braun tukee asiakkaita aktiivisesti tietojen hankkimisessa. Tätä varten vaatimustenmukaisuusvakuutukset ja käyttöohjeet (IFU) ovat olleet toukokuusta 2021 alkaen asteittain saatavilla digitaalisesti.
Vaatimustenmukaisuusvakuutukset löytyvät Internetistä osoitteesta www.bbraun.com. Syötä tuotteen nimi hakukenttään ja etsi vastaava vaatimustenmukaisuusvakuutus otsikon -liittyvät asiakirjat- alta. Useimmat B. Braun Melsungen AG:n ja B. Braun Avitum AG:n vaatimustenmukaisuusvakuutukset ovat saatavilla tämän kanavan kautta. Teknisistä syistä B. Braun pystyy tarjoamaan Aesculap AG:n tuotteiden vaatimustenmukaisuusvakuutuksia (ommelainevalikoimaa lukuun ottamatta) verkossa vain keskipitkällä aikavälillä. Jos vaatimustenmukaisuusvakuutuksia ei löydy verkosta, voit ottaa yhteyttä B. Braunin maakohtaisen tytäryhtiön asiakaspalveluun.
Käyttöohjeet voi ladata osoitteesta https://eifu.bbraun.com Tuotenumeron tai GTIN-numeron syöttämisen jälkeen näyttöön ilmestyvät tuotteeseen liittyvät asiakirjat.
Useimmat vahvistuskirjeet löytyvät osoitteesta bbraun.com vastaavien tuoteasiakirjojen alta. Jos niitä ei löydy verkosta, niitä voi pyytää kyseiseltä myyntiorganisaatiolta. Yleiskatsaus maaorganisaatioista löytyy täältä.
Ilmoitetun laitoksen vahvistuskirje viittaa asetukseen (EU) 2023/607 ja on vahvistuskirje. Ilmoitettu laitos vahvistaa tässä kirjeessä, että valmistaja (mukaan lukien kyseiset laitteet) noudattaa tämän asetuksen vaatimuksia. Nämä vahvistuskirjeet voidaan toimittaa asiakaspalvelun kautta.
MDR-asetuksessa määrätään vain, että laitteen turvallisen käytön tai implantoinnin aikaraja on ilmoitettava yksiselitteisesti vähintään vuosina ja kuukausina, mikäli sovellettavissa.
B. Braunin tuotteita, joiden viimeinen käyttöpäivä on merkitty kuukaudella ja vuodella, voidaan käyttää kuukauden loppuun asti.
Tässä on kokoelma hyödyllisiä linkkejä Euroopan komission virallisilla verkkosivustoilla ja muissa lähteissä oleviin tietoihin.
Tietolomake terveydenhuollon ammattilaisille (EU:n verkkosivusto)
link
EU-Journal: Lääkinnällisten laitteiden asetus
link
Ilmoitettujen laitosten luettelo (EU)
link
EUDAMED-aikajana (EU)
link
B. Braunin sähköiset käyttöohjeet (eIFU)
link
B. Braunin MDR-tietolomake
pdf, 53.7 KB
Kysymyksiä ja vastauksia MDR-asetuksen siirtymäsäännösten käytännön näkökohdista
link